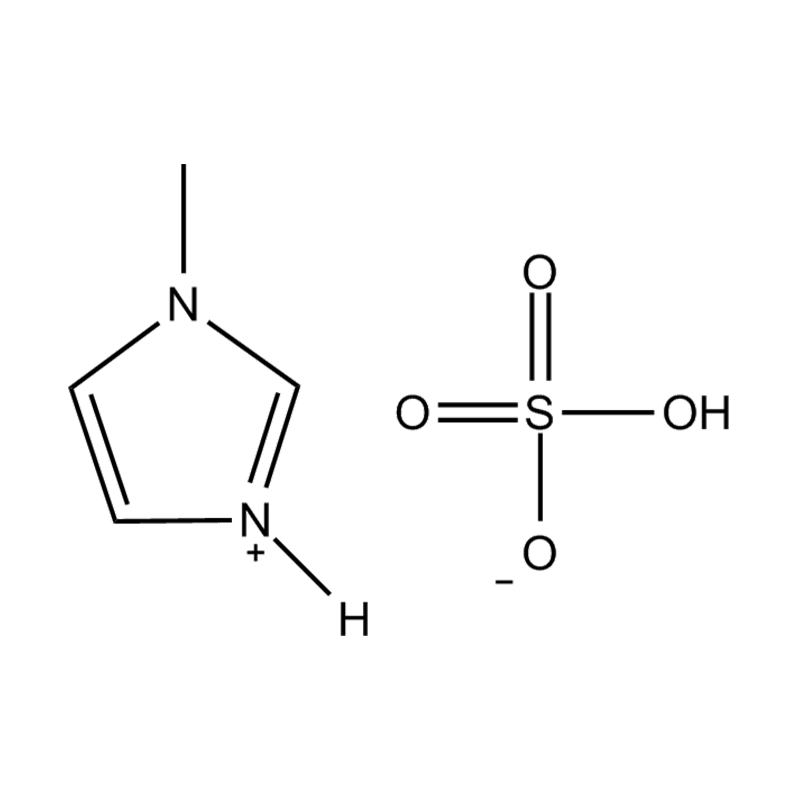
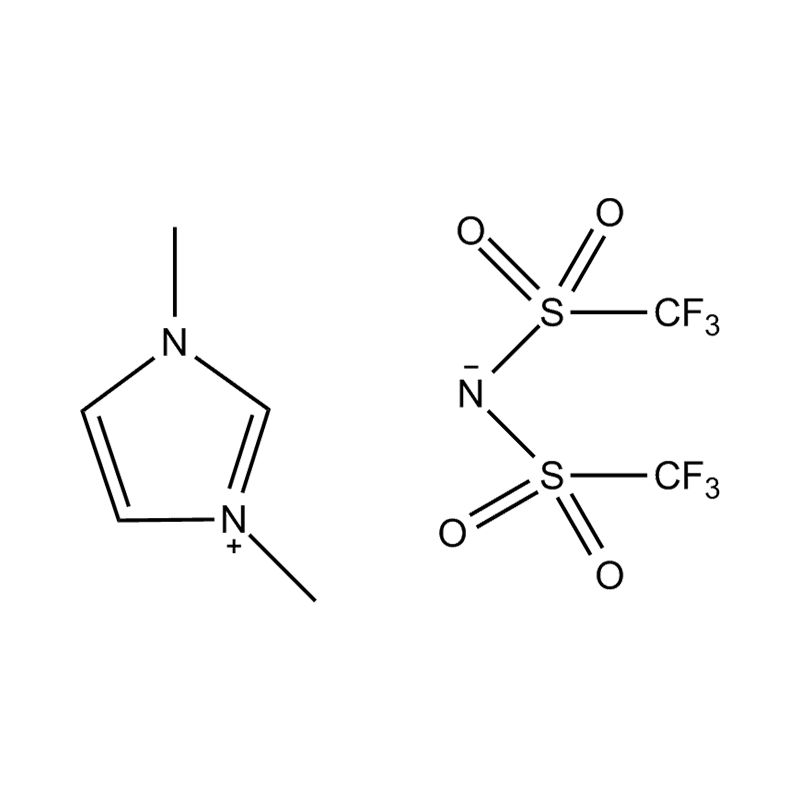
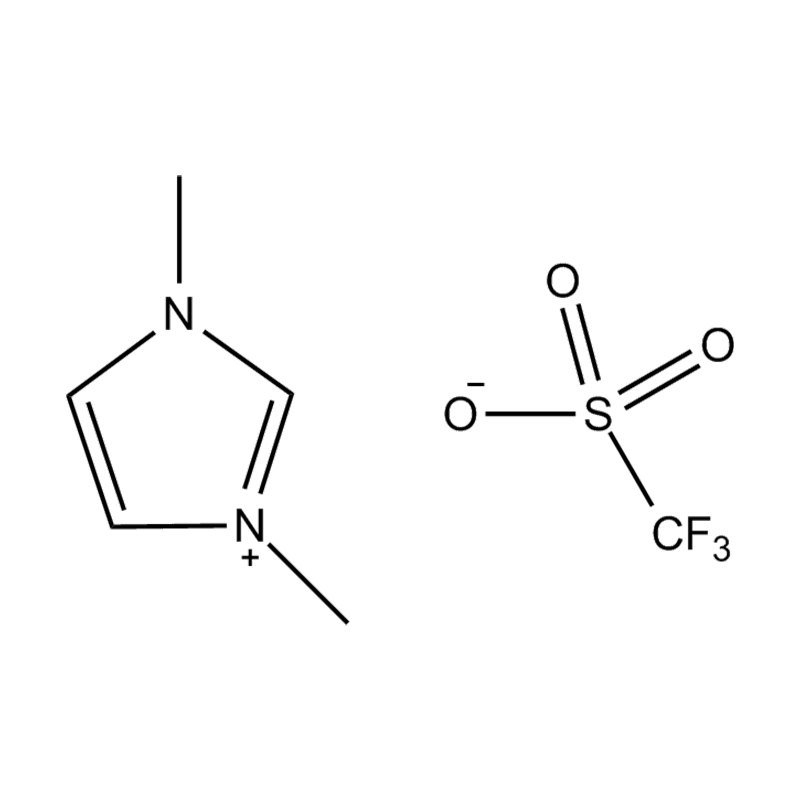
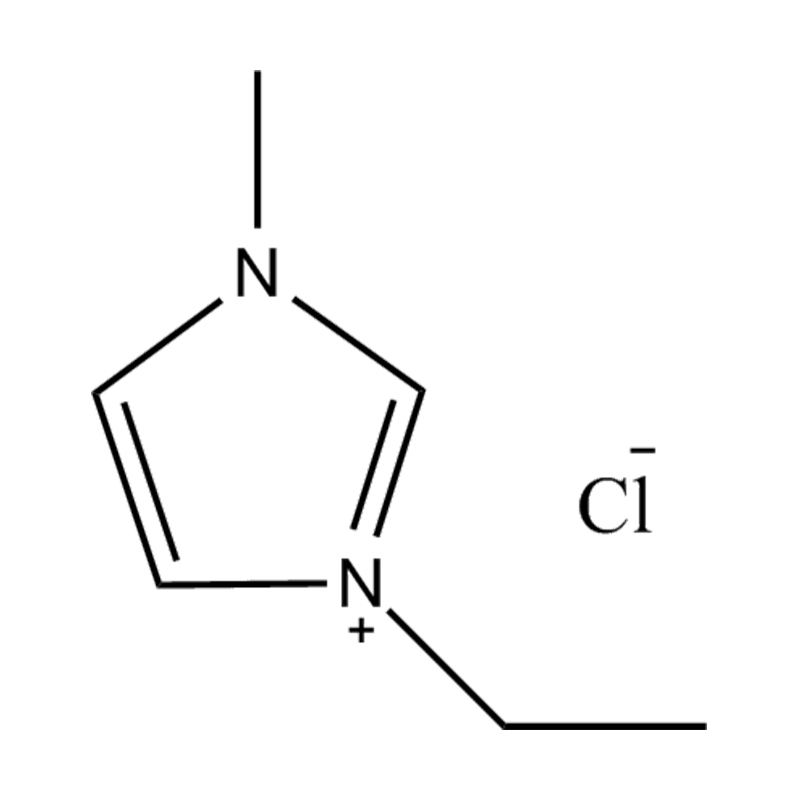
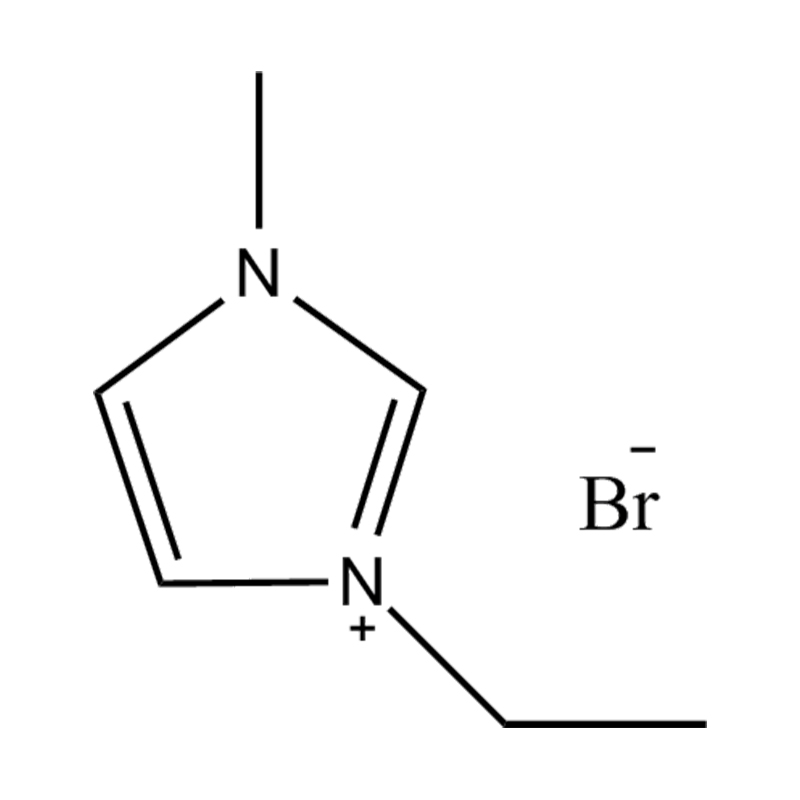
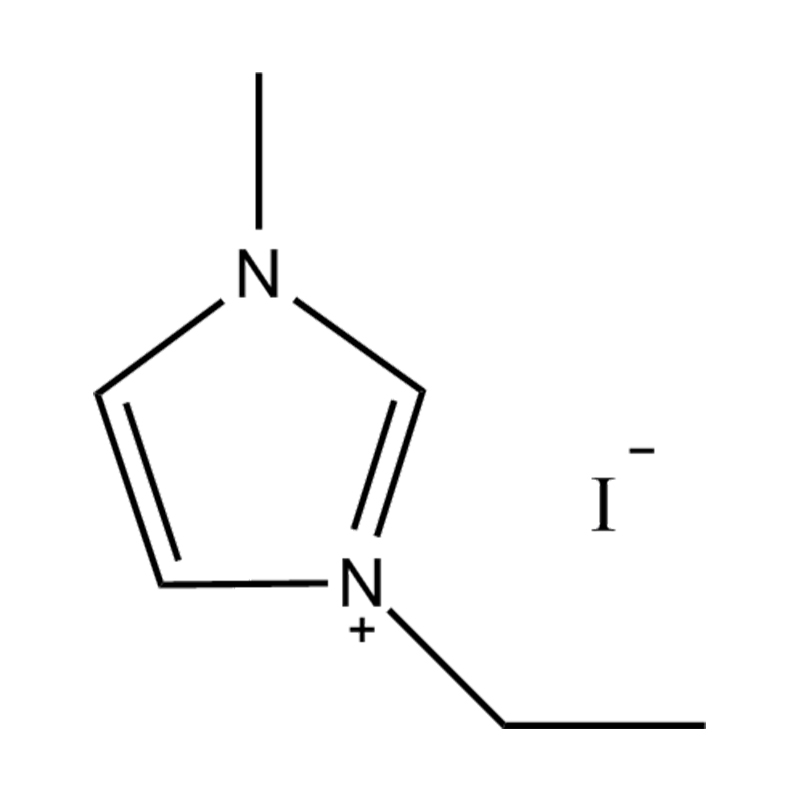
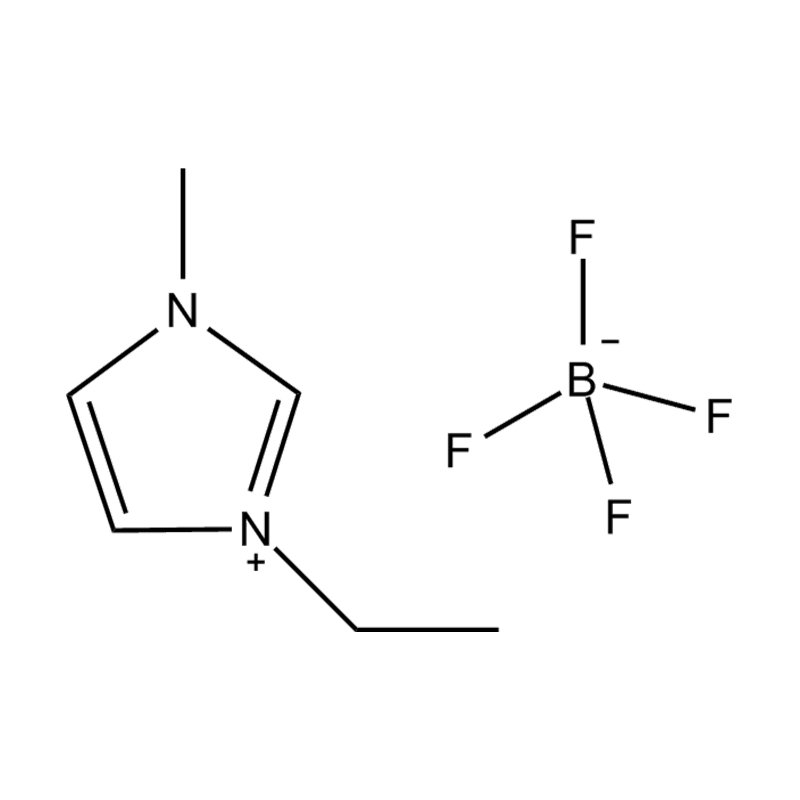
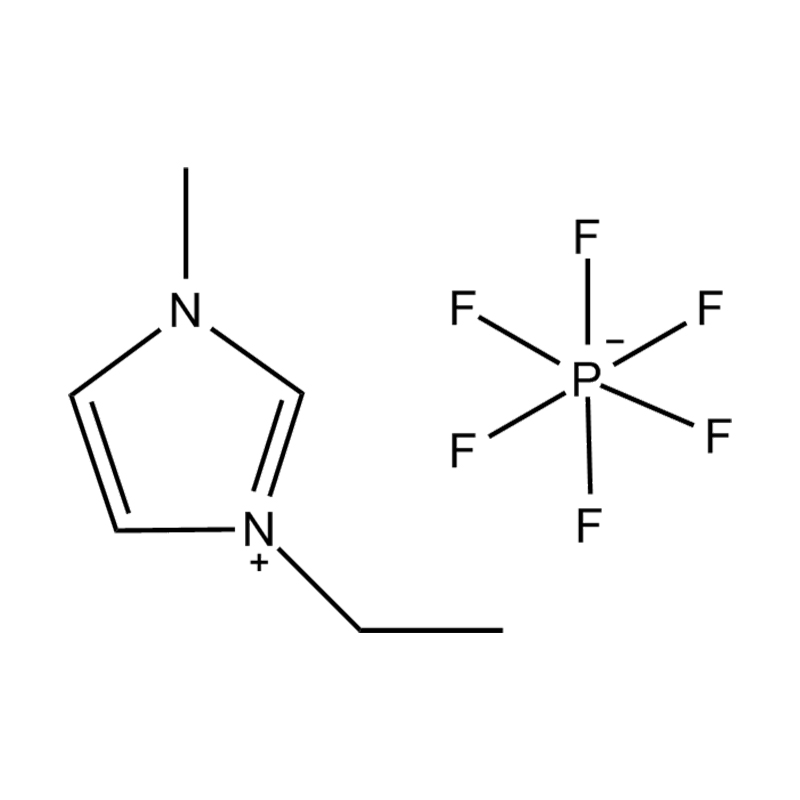
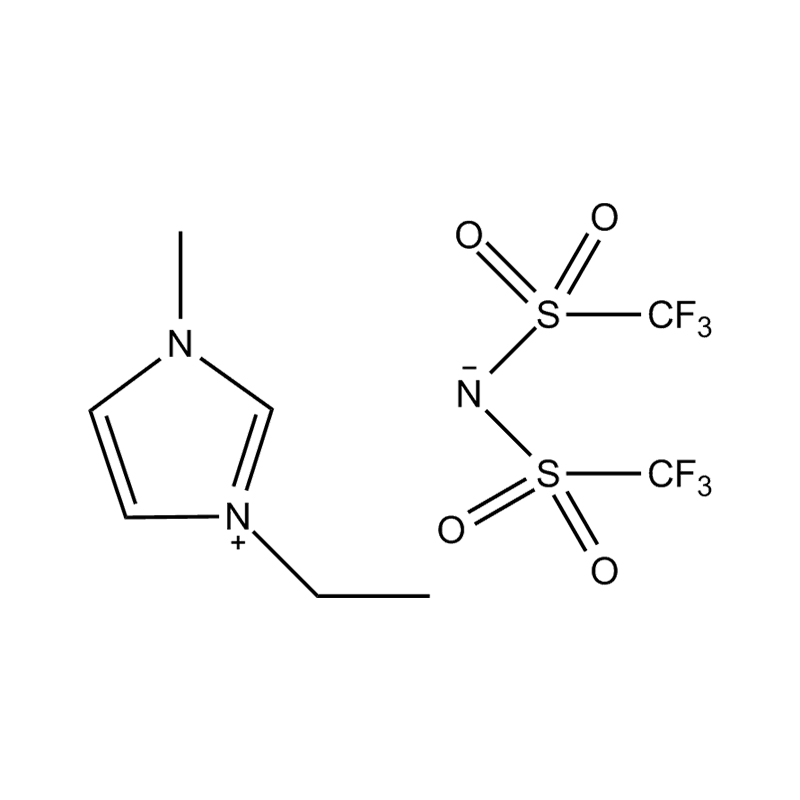
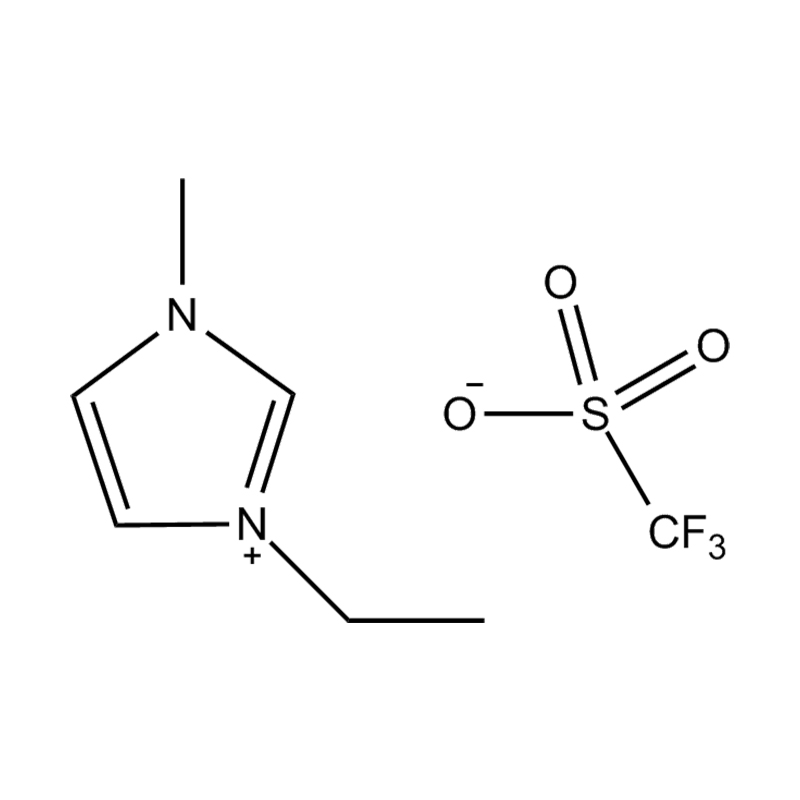
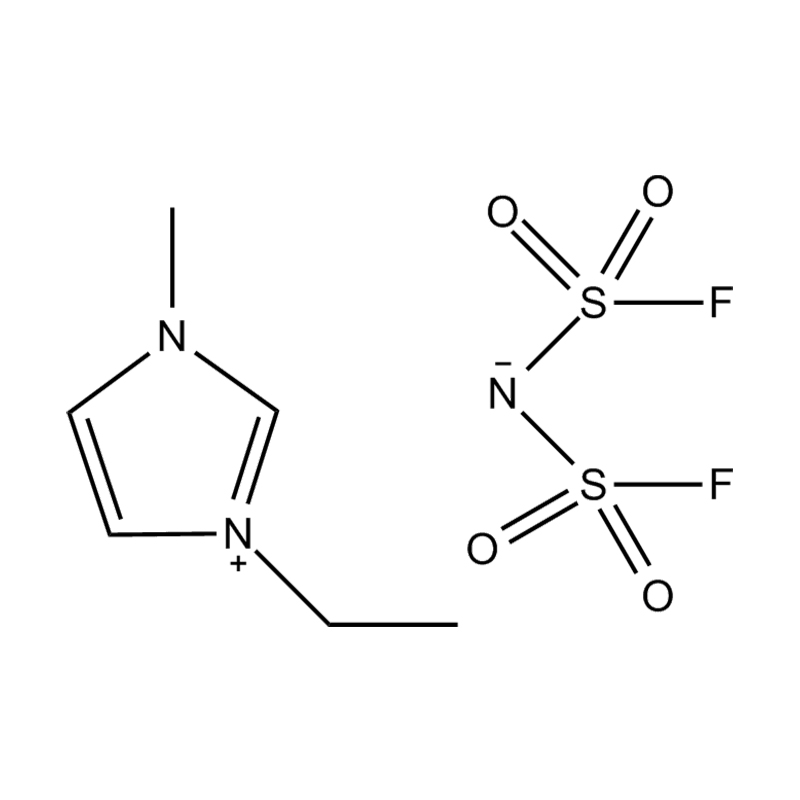
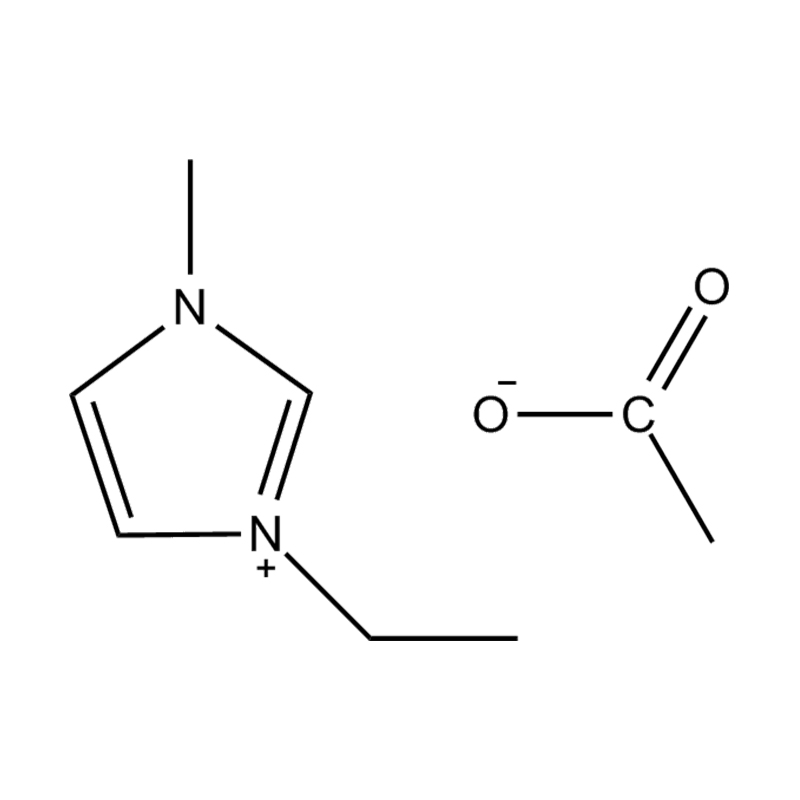
Die elektrochemische Stabilität von disubstituierte Imidazol -ionische Flüssigkeiten In Hochspannungs- oder redoxaktiven Umgebungen wird durch mehrere miteinander verbundene Mechanismen beeinflusst, die in ihrer molekularen Struktur und elektronischen Konfiguration verwurzelt sind:
Elektronendelokalisierung am Imidazolring: Die aromatische Natur des Imidazolrings ermöglicht eine signifikante Delokalisierung von π-Elektronen, was den Resistenz des Moleküls gegen oxidativen oder reduktiven Abbau erhöht. Bei der Er Substituation sowohl bei den 1- als auch bei 3-Positionen kann die elektronische Dichte so umverteilt werden, dass das Kation gegen Elektronentransferreaktionen stabilisiert.
Substituenteneffekte: Die Art und Position von Substituenten am Imidazolring beeinflussen die elektrochemische Stabilität erheblich. Elektronendonierende Gruppen können die Nucleophilie verbessern und die oxidative Stabilität verringern, während Elektronen-With-Drift-Gruppen (wie Halogene oder Nitrile) die oxidative Resistenz verbessern können, indem das höchste besetzte molekulare Orbital (HOMO) stabilisiert wird. Umgekehrt können diese Gruppen je nach Umwelt das Reduktionspotential durch Stabilisierung des niedrigsten nicht besetzten molekularen Orbitals (LUMO) senken.
Sterische Hinderung und räumliche Abschirmung: Sperrige Substituenten an den 1- und 3-Positionen können den Imidazoliumring physikalisch vor nukleophilen oder elektrophilen Angriffen schützen und unerwünschte Seitenreaktionen begrenzen, die unter hohen Spannungsbedingungen auftreten können.
Stabilität des Anionen-Kationspaares: Die Paarung des disubstituierten Imidazoliumkation mit einem stabilen, nicht koordinierenden Anion (z. B. Bis (Trifluormethylsulfonyl) Imid [tfsi⁻] oder Tetrafluoroborat [bf₄⁻]) reduziert die Lust auf die Vorschub und die Wahrscheinlichkeit der Vorschriften und die Vorausstände von der Leichung von Beilagen. Diese Anionen widersetzen die Zersetzung und halten die ionische Leitfähigkeit auf, ohne die Redoxreaktionen zu stören.
Ionenmobilität und Grenzflächenverhalten: In Hochspannungssystemen, insbesondere in elektrochemischen Geräten, beeinflussen die Mobilität von Ionen und ihre Organisation an Elektrodengrenzflächen die Stabilität. Dissstituierte imidazol-ionische Flüssigkeiten können gut organisierte Grenzflächenschichten bilden, die den direkten Elektronentransfer zwischen der Elektrode und der ionischen Spezies verhindern, wodurch ihr elektrochemisches Fenster verbessert wird.
Wärmestabilität und Zersetzungswege: Die intrinsische thermische Stabilität der disuubstituierten Imidazolstruktur minimiert das Risiko einer thermischen Zersetzung unter elektrochemischer Belastung, der häufig mit Spannungsinduzierungen abbaut.


 English
English Deutsch
Deutsch Español
Español 中文简体
中文简体